தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள் - நைட்ரிக் அமிலம் | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
நைட்ரிக் அமிலம்
நைட்ரிக் அமிலம்
தயாரித்தல்
சமஅளவு பொட்டாசியம் அல்லது சோடியம் நைட்ரேட்டை, அடர் கந்தக அமிலத்துடன் சேர்த்து வெப்பப்படுத்தி நைட்ரிக் அமிலம் தயாரிக்கப்படுகிறது.
KNO3 + H2SO4 → KHSO4 + HNO3
நைட்ரிக் அமிலம் சிதைவடைதலைத் தடுக்கும் பொருட்டு வெப்பநிலையானது முடிந்தவரை குறைவாக வைக்கப்படுகிறது.அமிலம் குளிர்ந்து புகையும் திரவமாக மாறுகிறது. நைட்ரிக் அமிலம் சிதைவடைந்து சிறிதளவு நைட்ரஜன் டை ஆக்சைடு உருவாவதால் இத்திரவம் பழுப்பு நிறமாக காட்சியளிக்கிறது.
4HNO3 → 4NO2 + 2H2O + O2
வணிக ரீதியிலான தயாரிப்பு முறை
ஆஸ்வால்ட் முறையைப் பயன்படுத்தி அதிகளவில் நைட்ரிக் அமிலம் தயாரிக்கப்படுகிறது. இம்முறையில், ஹேபர் முறையிலிருந்து உருவான அம்மோனியாவானது பத்து மடங்கு காற்றுடன் கலக்கப்படுகிறது. இக்கலவையானது வெப்பப்படுத்தப்பட்டு, வினைவேகமாற்றி வைக்கப்பட்டுள்ள தனி அறையினுள் செலுத்தப்படுகிறது, அங்கு பிளாட்டின கம்பி வலையுடன் தொடர்பு உண்டாக்கப்படுகிறது. வெப்பநிலை 1275 K க்கு உயர்த்தப்படும்போது, உலோக வலையானது விரைவாக அம்மோனியாவை ஆக்ஸிஜனேற்றம் செய்து NO வாயுவை உருவாக்குகிறது, பின்னர் அது நைட்ரஜன் டையாக்சைடாக ஆக்ஸிஜனேற்றம் அடைகிறது.
4NH3 + 5O2 → 4NO + 6H2O + 120 kJ
2NO + O2 → 2NO2
இவ்வாறு தயாரிக்கப்பட்ட நைட்ரஜன் டை ஆக்சைடு வாயு வரிசையாக அமைக்கப்பட்டுள்ள பரப்புகவர் கோபுரங்களின் வழியாக செலுத்தப்படுகிறது. இது நீருடன் வினைப்பட்டு நைட்ரிக் அமிலத்தை தருகிறது. உருவாக்கப்பட்ட நைட்ரிக் அமிலமானது காற்று செலுத்தி வெளுக்கப்படுகிறது.
3NO2 + H2O → 2HNO3 + NO
பண்புகள்
தூய நைட்ரிக் அமிலம் நிறமற்றது. இதன் கொதிநிலை 86 °C. இந்த அமிலம், நீருடன் முழுமையாக கலந்து கொதிநிலை மாறா கலவையை உருவாக்குகிறது (98% HNO3, கொதிநிலை 120.5 °C). புகையும் நைட்ரிக் அமிலம் நைட்ரஜனின் ஆக்ஸைடுகளை கொண்டுள்ளது. இது, சூரிய ஒளிக்கு வெளிப்படும்போதோ அல்லது வெப்பப்படுத்தப்படும்போதோ சிதைவடைந்து நைட்ரஜன் டை ஆக்சைடு, நீர் மற்றும் ஆக்ஸிஜனாக மாறுகிறது.
4HNO3 → 4NO2 + 2H2O + O2
இந்த வினையின் காரணமாக தூய அமிலம் அல்லது அதன் அடர்க் கரைசலானது மஞ்சள் நிறமாக மாறுகிறது. பெரும்பாலான வினைகளில் நைட்ரிக் அமிலம் ஆக்ஸிஜனேற்றியாக செயல்படுகிறது. எனவே, ஆக்ஸிஜனேற்ற நிலை +5 லிருந்து குறைந்தபட்ச மதிப்பிற்க்கு மாற்றமடைகிறது. இது உலோகங்களுடன் வினைப்பட்டு ஹைட்ரஜனைத் தருவதில்லை. நைட்ரிக் அமிலமானது, அமிலமாகவும், ஆக்ஸிஜனேற்ற காரணியாகவும் மற்றும் நைட்ரோ ஏற்றக் காரணியாகவும் செயல்படுகிறது.
அமிலமாக : இது, மற்ற அமிலங்களைப் போன்றே காரங்கள் மற்றும் கார ஆக்ஸைடுகளுடன் வினைப்பட்டு நீரையும் உப்புக்களையும் உருவாக்குகிறது.
ZnO + 2HNO3 → Zn(NO3)2 + H2O
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5 H2O
ஆக்ஸிஜனேற்றக் காரணியாக: கார்பன், சல்பர், பாஸ்பரஸ் மற்றும் அயோடின் போன்ற அலோகங்கள் நைட்ரிக் அமிலத்தால் ஆக்ஸிஜனேற்றமடைகின்றன.
C + 4HNO3 → 2H2O + 4NO2 + CO2
S + 2HNO3 → H2SO4 + 2NO
P4 + 20HNO3 → 4H3PO4 + 4H2O + 20NO2
3I2 + 10HNO3 → 6HIO3 + 10NO + 2H2O
HNO3 + F2 → HF + NO3F
3H2S + 2HNO3 → 3S + 2NO + 4H2O
நைட்ரோ ஏற்றக் காரனியாக: பொதுவாக கரிம சேர்மங்களில் ஒரு - H அணுவை – NO2 தொகுதி கொண்டு பதிலீடு செய்தல் நைட்ரோ ஏற்றம் என குறிப்பிடப்படுகிறது. எடுத்துக்காட்டாக,
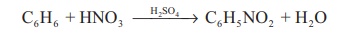
C6H6 + HNO3 → H2SO4 → C6H5NO2 + H2O
நைட்ரோனியம் அயனி உருவாவதன் காரணமாக நைட்ரோ ஏற்றம் நிகழ்கிறது.
HNO3 + H2SO4 → NO2+ + H3O+ + HSO4-
உலோகங்கள் மீதான நைட்ரிக் அமிலத்தின் வினை
தங்கம், பிளாட்டினம், ரோடியம், இரிடியம் மற்றும் டாண்டுலம் போன்றவற்றைத் தவிர மற்ற எல்லா உலோகங்களும் நைட்ரிக் அமிலத்துடன் வினைபுரிகின்றன. நைட்ரிக் அமிலம் உலோகங்களை ஆக்ஸிஜனேற்றம் அடையச் செய்கிறது. அலுமினியம், இரும்பு, கோபால்ட் மற்றும் குரோமியம் போன்ற சில உலோகங்கள் அடர் நைட்ரிக் அமிலத்துடன் வினைப்படும்போது, அவற்றின் உலோகப் பரப்பின் மீது ஆக்ஸைடு அடுக்கு உருவாவதால் வினை செயலற்றதாகிறது. தூய உலோகத்துடன் நைட்ரிக் அமிலம் தொடர்ந்து வினைபுரிவதை இந்த ஆக்சைடு அடுக்கு தடுக்கிறது.
நைட்ரிக் அமிலமானது டின், ஆர்சனிக், அன்டிமனி மற்றும் மாலிப்டினம் போன்ற குறைந்த நேர்மின் தன்மை கொண்ட உலோகங்களுடன் உலோக ஆக்ஸைடுகளை உருவாக்குகிறது. இந்த ஆக்சைடுகளில் உலோகமானது உயர் ஆக்ஸிஜனேற்ற நிலையில் காணப்படுகிறது. மேலும் அமிலமானது குறைந்த ஆக்ஸிஜனேற்ற நிலைக்கு ஒடுக்கப்படுகிறது. நைட்ரிக் அமிலம் உலோகங்களுடன் வினைப்படும்போது NO2, NOவாயு மற்றும் H2O ஆகியன மிகப்பொதுவாக உருவாகும் விளைபொருட்களாகும். மிக அரிதாக N2, NH2OH மற்றும் NH3 ஆகியவனவும் உருவாக்கப்படுகின்றன.
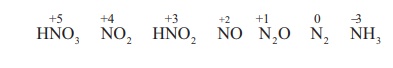
உலோகங்கள், நைட்ரிக் அமிலத்துடன் வினைபுரிவதை பின்வரும் மூன்று படிகளின் மூலம் விளக்கலாம்.
முதல் நிலை வினை: பிறவிநிலை ஹைட்ரஜன் வெளியேற்றப்பட்டு உலோக நைட்ரேட் உருவாக்கப்படுகிறது.
M+ HNO3 → MNO3 + (H)
இரண்டாம் நிலை வினை: பிறவிநிலை ஹைட்ரஜன், நைட்ரிக் அமிலத்தின் ஒடுக்க விளைப்பொருட்களை உருவாக்குகிறது.
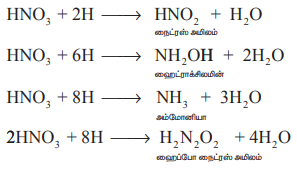
HNO3 + 2H → HNO2 + H2O
நைட்ரஸ் அமிலம்
HNO3 + 6H → NH2OH + 2H2O
ஹைட்ராக்சிலமின்
HNO3 + 8H → NH3 + 3H2O
அம்மோனியா
2HNO3 + 8H → H2N2O2 +4H2O
ஹைப்போ நைட்ரஸ் அமிலம்
மூன்றாம் நிலை வினை: இரண்டாம் நிலை விளைப்பொருட்கள் சிதைவடைந்தோ அல்லது தொடர்ந்து வினைபுரிந்தோ இறுதி விளைப்பொருட்களை தருகின்றன.
இரண்டாம் நிலை விளைபொருட்களின் சிதைதல் :
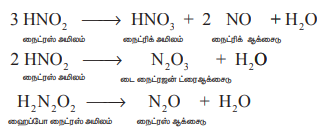
3 HNO2 → HNO3 + 2 NO + H2O
நைட்ரஸ் அமிலம் நைட்ரிக் அமிலம் நைட்ரிக் ஆக்சைடு
2 HNO2 → N2O3 + H2O
நைட்ரஸ் அமிலம் டை நைட்ரஜன் ட்ரைஆக்சைடு
H2N2O2 → N2O + H2O
ஹைப்போ நைட்ரஸ் அமிலம் நைட்ரஸ் ஆக்சைடு
இரண்டாம் நிலை விளைபொருட்களின் தொடர் வினை:
HNO2 + NH3 → N2 + 2H2O
HNO2 + NH2 OH → N2O + 2H2O
HNO2 + HNO3 → 2NO2 + H2O
எடுத்துக்காட்டுகள்:
காப்பர், நைட்ரிக் அமிலத்துடன் பின்வருமாறு வினைபுரிகிறது
3Cu + 6HNO3 → 3Cu(NO3)2 + 6(H)
6(H) + 3HNO3 → 3HNO2 + 3H2O
3HNO2 → HNO3 + 2NO + H2O
ஒட்டுமொத்த வினை
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
அடர் அமிலமானது, நைட்ரஜன் டை ஆக்ஸைடை உருவாக்கும் திறனைப் பெற்றுள்ளது.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
மெக்னீஷியம், நைட்ரிக் அமிலத்துடன் பின்வருமாறு வினைபுரிகிறது.
4Mg + 8HNO3 → 4Mg(NO3)2 +8[H]
HNO3+ 8H → NH3 + 3H2O
HNO3+ NH3 + NH4NO3
ஒட்டுமொத்த வினை
4Mg + 10HNO3 → 4Mg(NO3)2+ NH4NO3 + 3H2O
அமிலம் நீர்க்கப்பட்டிருந்தால், N2O பெறப்படுகிறது
4Mg + 10HNO3 → 4Mg(NO3)2+ + N2O + 5H2O
நைட்ரிக் அமிலத்தின் பயன்கள்:
1. இராஜ திராவகம் தயாரித்தலில் ஆக்சிஜனேற்றியாக நைட்ரிக் அமிலம் பயன்படுகிறது.
2. நைட்ரிக் அமில உப்புகள் புகைப்படத் தொழிலிலும் (AgNO3), துப்பாக்கிகளுக்கு தேவையான வெடிமருந்துகளிலும் (NaNO3)பயன்படுகின்றன.
தன் மதிப்பீடு :
ஜிங்க் உடன் நைட்ரிக் அமிலம் (நீர்த்த மற்றும் அடர்)வினைப்படும்போது உருவாகும் விளைப்பொருட்களை எழுதுக.